


 |
 |
 |
EE07 - O ELÉTRON LIVRE
traduzido do sítio: http://www.nde-ed.org/EducationResources/HighSchool/Electricity/freeelectron.php

Após ler essa seção você estará apto ao seguinte:
Mantendo o balanço elétrico

Hidrogênio, cujo átomo está representado a esquerda da figura, é o elemento químico mais simples. Ele possui um próton no seu núcleo e um elétron na sua núvem de elétrons.
Hélio, cujo átomo está representado a direita da figura, consiste de dois prótons no núcleo e dois eétrons na sua nuvem de elétrons
O átomo de cobre
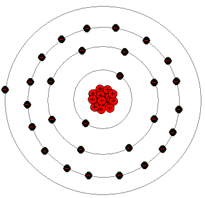
A figura a direita representa o átomo de cobre, que é muito mais complexo que os átomos de hidrogênio e de hélio.
O átomo de cobre possui 29 prótons no núcleo com 29 elétrons orbitando o núcleo. Observe que no átomo de cobre, os elétrons são arrumados em várias níveis de energia chamados de camadas. Assim representa-se graficamente que os elétrons estão em diferentes níveis de energia do átomo. A energia do elétrom está distribuida em níveis particulares de energia. Esses níveis de energia ou camadas seguem um comportamento bastante previsível. A camada mais próxima do núcleo possui apenas 2 elétrons. A segunda camada pode possuir até 8 elétrons. A terceira camada pode ter até 18 elétrons. A quarta camada comporta até 32 elétrons. Os átomos podem ter muitos elétrons, mas esses elétrons serão distribuidos então em várias camadas diferentes. A maior distância entre os elétrons das camadas mais afastadas do núcleo (que contem os prótons) implica em uma menor força de atração que esses elétrons sofrerão, comparado com a força de atração que experimentam os elétrons das camadas mais próximas do núcleo.
No próximo ítem você aprenderá sobre a camada mais externa do átomo conhecida como camada de valência.

https://rocarneval.neocities.org/EE_07-EletronLivre.html
PÁGINA ANTERIOR https://rocarneval.neocities.org/EE_06-CargaEletrica.html
PRÓXIMA PÁGINA https://rocarneval.neocities.org/EE_08-ValenciaCamada.html
INDICE https://rocarneval.neocities.org/EE_00-Indice(Eletricidade).html
 |
 |
 |
| |
![]()